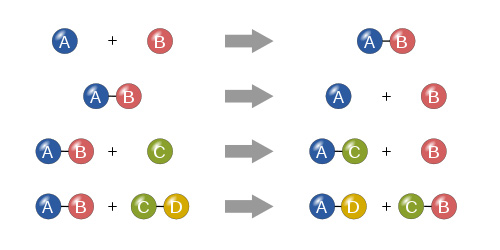
یک «واکنش شیمیایی» (Chemical reaction) فرایندی است که منجر به تعامل بین مواد شیمیایی میگردد. موادی که در ابتدا در واکنش شیمیایی شرکت میکنند را «واکنشدهنده» (reactants) مینامند. موادی که طی واکنش تولید میگردند «محصولات» (products) نامگذاری میشوند. با توجه به اینکه واکنشهای شیمیایی معمولا توسط یک تغییر شیمیایی مشخص میگردند، محصولات تولید شده عموما متفاوت از واکنشدهندهها هستند.
به شکل کلاسیک، واکنشهای شیمیایی مجموعهای از تغییرات هستند که شامل حرکت شدید الکترونها در تشکیل و شکستن پیوندهای شیمیایی میشوند. با این حال، مفهوم کلی یک واکنش شیمیایی، به ویژه مفهوم یک معادلهی شیمیایی، برای تغییرات ذرات ابتدایی و واکنشهای هستهای کاربردی است.
یک سری از واکنشهای شیمیایی مختلف ممکن است برای تولید یک محصول مناسب انجام شود. در «بیوشیمی» (biochemistry)، مجموعهای از واکنشهای شیمیایی که توسط آنزیمها کاتالیز میشوند، مسیرهای سوختوساز را تشکیل میدهند. این واکنشها تحت شرایط عادی به هیچ روی رخ نمیدهند.
واکنشهای شیمیایی درون هر موجود زندهای رخ داده و به موجودات اجازهی زنده ماندن، رشد و تکثیر میدهند. علاوه بر این، محققان و «مهندسان شیمی» (chemical engineer) از واکنشهای شیمیایی برای تولید آرایش وسیعی از مواد، از جمله فرآوردههای پتروشیمی، مواد شیمیایی کشاورزی، سرامیکها، پلیمرها و لاستیکها (الاستومرها)، روغنهای پایهی طبیعی (روغن، چربی و واکس)، مواد منفجره، عطر و طعمها استفاده میکنند. جامعهی مدرن به شدت به این محصولات وابسته است.

معادلههای شیمیایی
یک واکنش شیمیایی به صورت نمادین توسط یک «معادلهی شیمیایی» (chemical equation) نشان داده میشود؛ جایی که مجموعهای از مواد، واکنشدهندهها، به مجموعهی دیگری از مواد یا محصولات، تبدیل میگردند. واکنشدهندهها و محصولات با استفاده از فرمول شیمیایی آنها نشان داده میشود و یک فلش برای نمایش جهت واکنش به کار میرود. واکنشدهندهها معمولا در سمت چپ و محصولات در سمت راست قرار میگیرند. اگر واکنش غیر برگشتپذیر باشد، از یک فلش تنها و در صورت برگشتپذیر بودن واکنش از دو فلش (در جهات مخالف) استفاده میشود.
به عنوان مثال احتراق متان در حضور اکسیژن توسط معادلهی زیر بیان میگردد:
CH4 + 2 O2 → CO2 + 2 H2O
این معادله نشاندهندهی یک واکنش غیر برگشتپذیر است که در آن یک مولکول متان با دو مولکول اکسیژن واکنش داده و یک مولکول کربندیاکسید و دو مولکول آب تولید میشود.
انواع واکنش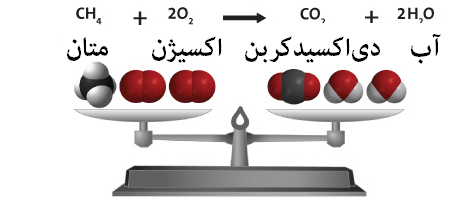
تنوع بیشمار واکنشهای شیمیایی و روشهای مطالعهی آنها منجر به پدید آمدن دستهبندیهای متعدد شده است که گاه با یکدیگر همپوشانی دارند. در ادامه نمونههایی از اصطلاحات دارای کاربرد گسترده برای توصیف انواع واکنشهای معمول بیان شده است.
ایزومریزاسیون
در واکنش «ایزومریزاسیون یا همپاری» (isomerization) یک ترکیب شیمیایی دستخوش یک بازسازی ساختاری بدون هیچ تغییری در ترکیب اتمی خالص خود میگردد؛ همانند ایزومرهای فضایی.
ترکیب مستقیم یا سنتز
در این حالت دو تا تعداد بیشتری عنصر یا ترکیب برای تشکیل یک محصول پیچیده به هم میپیوندند. برای نمونه واکنش زیر را که در دستهی «سنتز» (Direct combination or synthesis) قرار میگیرد، در نظر بگیرید که در آن یک اتم نیتروژن با سه اتم هیدروژن واکنش داده و دو اتم آمونیاک تولید میگردد. آمونیاک یکی از محصولات مهم صنعتی و خوراک اصلی واحد تولید «اوره» (urea) است.
N2 + 3 H2 → 2 NH3
تجزیهی شیمیایی یا آنالیز
طی واکنش «تجزیه شیمیایی» (Chemical decomposition or analysis) یک ترکیب به ترکیبات یا عناصر کوچکتر تجزیه میگردد. مثالی در این گروه را میتوانید در تجزیه آب به دو عنصر هیدروژن و اکسیژن مشاهده نمایید.
2 H2O → 2 H2 + O2
واکنش جابهجایی یا جانشینی یگانه
در این نوع واکنش یک عنصر واکنشپذیرتر جایگزین یک عنصر دیگر در ترکیب مورد نظر میشود. از واکنشهای «جابهجایی یا جانشینی یگانه» (Single displacement or substitution) به نمونه زیر میتوان اشاره کرد که در آن اتم سدیم جای اتم هیدروژن را در ترکیب آبی هیدروکلریک اسید میگیرد.
(2Na (s) + 2 HCl (aq) → 2 NaCl (aq) + H2 (g
واکنش جانشینی دوگانه
در «واکنش جانشینی دوگانه» (Metathesis or Double displacement reaction)، یونها یا پیوندهای دو ترکیب برای تشکیل ترکیبات مختلف مبادله میشوند. برای نمونه در این واکنش در محیط آبی که با نشانهی «aq» (مخفف aquoues) مشخص شده است، یون کلرید و نیترات جای خود را در ترکیبات مذبور با یکدیگر عوض میکنند.
(NaCl (aq) + AgNO3 (aq) → NaNO3 (aq) + AgCl (s
واکنشهای اسید و باز
واکنشی را که بین یک اسید و یک باز صورت میگیرد، «واکنش اسید و باز» (acid-base reaction) مینامند. این واکنش میتواند با توجه به مفهوم اسید و باز به کار گرفته شده، تعاریف متفاوتی داشته باشد. برخی از رایجترین آنها عبارتند از:
تعریف «آرنیوس» (Arrhenius): انحلال اسیدها و بازها در آب به ترتیب منجر به آزاد شدن یونهای H3O+ و OH– میشود.
تعریف «برونستد-لوری» (Brønsted-Lowry): طبق این تئوری اسید مادهای است که پروتون (H+) از دست میدهد و باز مادهای است که پروتون میگیرد. این تئوری، تئوری آرنیوس را نیز شامل میشود.
تعریف «لوویس» (Lewis): در این نظریه، اسیدها و بازها به این صورت تعریف میشوند که مولکولی که بتواند جفت الکترون غیر پیوندی از مولکول دیگری دریافت کند اسید و مولکول دهنده جفت الکترون باز است.
واکنش اکسایش-کاهش
واکنشهایی را که در آن تغییراتی در عدد اکسایش اتمها در گونههای درگیر رخ میدهد، اکسایش – کاهش (Redox) مینامند. این واکنشها را اغلب میتوان به صورت انتقال یک یا چند الکترون از یک اتم، مولکول یا یون به یک اتم، مولکول یا یون دیگر تفسیر کرد.

در هر واکنش اکسایش و کاهش اتم یا مولکولی الکترون از دست میدهد (اکسایش) و اتم یا مولکولی دیگر الکترون جذب میکند (کاهش) مییابد. مثال زیر نمونهای از واکنش اکسایش کاهش است. در این مثال I2 (یون) به I– (آنیون ید) کاهش و –S2O32 (آنیون تیوسولفات) به –S4O62 اکسایش مییابد.
(2S2O32−(aq) + I2(aq) → S4O62−(aq) + 2 I−(aq
احتراق
یک نوع واکنش اکسایش کاهش است که در آن هر مادهی قابل احتراقی با یک عنصر اکسید کننده، معولا اکسیژن، ترکیب میشود. در نتیجه این واکنش گرما و محصولات اکسید شده تولید میشوند. احتراق اگرچه یک نوع واکنش اکسایش است، اما به خاطر سرعت بالای واکنش که باعث ایجاد گرمای زیاد در زمان اندک و بالا رفتن دمای محیط واکنش و ایجاد نور و شعله میشود، در دستهای خاص قرار میگیرد. به عنوان مثال، اکسیداسیون کنترل شدهی یک گروه تک عاملی، احتراق محسوب نمیشود. در ادامه واکنشهای احتراق با اکسندههای قوی اکسیژن و فلوئور را مشاهده مینمایید.
C10H8+ 12 O2 → 10 CO2 + 4 H2O
CH2S + 6 F2 → CF4 + 2 HF + SF6

واکنشها همچنین میتوانند بر اساس مکانیسم آنها طبقهبندی شوند. بعضی نمونههای آن عبارتند از:
واکنش یونها (این نوع واکنش جابهجایی اتمها یا الکترونهای ظرفیتِ بین اتم یا یونهای یکسان است بهگونهایکه محصولات متفاوت حاصل شود. از این دست میتوان به «گسست ناهمگن» (disproportionation) هیپوکلریت اشاره کرد.)
واکنش با ترکیبهای میانی یونی (واکنشی مثل واکنشهای «انولات» (enolate) در این دسته جای میگیرند. )
واکنشهای رادیکالی مانند احتراق در دمای بالا
واکنش «کاربنها» (carbene) (کاربن در علم شیمی به ترکیباتی گفته میشود که از یک اتم خنثی کربن با دو الکترون به اشتراک گذاشته نشده، تشکیل شده باشد. فرمول کلی این ترکیبات به صورت ‘R-(C:)-R یا :C=R است.)
واکنشهای آلی
«واکنشهای آلی» (Organic reactions) دستهی وسیعی از واکنشها هستند و ترکیباتی را شامل میشوند که کربن عنصر اصلی در ساختار مولکولی آنها است. واکنشهایی که در آنها یک ترکیب آلی ممکن است شرکت کند، عموما توسط گروه عاملی آن تعریف میگردد. باید بدانید که اتم کربن یک اتم چهار ظرفیتی است. این ویژگی یکی از دلایل عمده گستردگی و تنوع واکنشهای آلی به شمار میرود.

هیچ محدودیتی برای تعداد مکانیسمها و واکنشهای آلی ممکن وجود ندارد. اگرچه، الگوهای عمومی معینی مشاهده میشوند که میتوانند برای شرح بسیاری از واکنشهای مفید یا رایج استفاده شوند. هر واکنش دارای یک مکانیسم واکنش گام به گام است که چگونگی اتفاق افتادن آن را توضیح میدهد. واکنشهای آلی میتوانند به چندین نوع اساسی سازماندهی گردند. بعضی واکنشها به بیش از یک دسته تقسیم میشوند. بعضی از انواع اساسی واکنشهای شیمیایی آلی در ادامه ذکر شدهاند.
واکنش افزایشی
بعضی واکنشها مانند «هالوژندار کردن» (halogenation)، «هیدرو هالوژندار کردن» (hydrohalogenation)، «آبپوشی یونها یا هیدراسیون» (hydration) در دستهی «واکنشهای افزایشی» (Addition reaction) قرار میگیردند. بر اساس مکانیسم، واکنشهای اضافی اصلی به افزایشی «الکتروندوست» (electrophilic)، «هستهدوست» (nucleophilic)، «رادیکالی» (radical) طبقهبندی میگردند.
واکنش افزایشی گونهای از واکنش شیمیایی است که طی آن دو یا چند مولکول ساده با یکدیگر ادغام شده و تشکیل مولکول بزرگتری را میدهند. در ادامه اسامی مذکور برای فهم بهتر توضیح داده میشود.
هالوژندار کردن: دستهای از واکنشهای شیمیایی هستند که در آن یک یا چند اتم هالوژن به یک ساختار شیمیایی متصل میشوند.
واکنش هیدراسیون: در شیمی آلی، واکنشی است که در آن یک هیدروکسیل گروه (OH–) و یک یون مثبت (پروتن اسیدی) به دو اتم کربن افزوده میشود.
الکترون دوست: گونهای شیمیایی است که دارای بار مثبت بوده و تمایل به دریافت الکترون جهت خنثی شدن دارد.
هستهدوست یا نوکلئوفیل: گونهای شیمیایی است که به یک الکترون دوست برای تشکیل یک پیوند شیمیایی، زوج الکترون میدهد.
واکنشهای حذفی
«واکنشهای حذفی» (Elimination reactions) شامل فرآیندهایی مانند «دیهیدراسیون» (dehydration) میشوند.
واکنش حذفی: گونهای واکنش آلی است که در آن دو جانشین در یک فرایند یک یا دو گامی، از یک مولکول حذف میشود.
واکنش جانشینی
«واکنشهای جانشینی» (Substitution reaction) به چندین نوع تقسیم میشوند: «جانشینی هستهدوستی آلیفاتیک» (nucleophilic aliphatic substitution) با SN1، SN2 و مکانیسمهای واکنش SNi، «جانشینی هستهدوستی آروماتیک» (nucleophilic aromatic substitution)، «جانشینی هستهدوست آسیل» (nucleophilic acyl substitution)، «جانشینی الکترون دوست» (electrophilic substitution)، «جانشینی الکترون دوست آروماتیکی» (Electrophilic aromatic substitution) و «جانشینی رادیکالی» (radical-substitution).
واکنش جانشینی: گونهای از واکنشهای شیمیایی است که طی آن یک گروه عاملی از یک ترکیب با گروه دیگری از ترکیب دیگر جابجا میشوند.
جانشینی هسته دوست آروماتیک: گونهای از واکنشهای جانشینی در شیمی آلی است که در آن یک عامل هسته دوست با یک گروه ترککننده مانند یک هالید از روی حلقهی آروماتیک جابجا میشود.
جانشینی هستهدوستی آسیل: نوعی از واکنشهای جانشینی را معرفی میکند که شمال یک ترکیب هستهدوست و یک آسیل هستند. در این نوع از واکنش، یک ترکیب هسته دوست مانند الکل، آمین یا انولات به جای گروه جداشوندهی مشتقات آسیل مانند یک اسید هالید، انهیدرید یا استر مینشیند.
جانشینی الکتروندوست آروماتیکی: گونهای از واکنش آلی است که طی آن یکی از اتمهای متصل به حلقهی آروماتیک (معمولا هیدروژن) جای خود را با یک الکترون دوست عوض میکند.
جانشینی رادیکالی: در شیمی آلی واکنشی است که در آن واسطههای رادیکال در یک واکنش جابهجایی شرکت میکنند.
واکنشهای اکسایش کاهش آلی
این دسته واکنشهای اکسایشی-کاهشیاند که در میان ترکیبهای آلی روی میدهند. «واکنشهای اکسایش کاهش آلی» (Organic redox reactions) در عمل بسیار رایج هستند.
واکنش بازآرایی
این طبقه به سه دستهی «بازآرایی-2،1» (1,2-rearrangement)، «واکنش پریسایکلیک» (pericyclic reaction) و «واکنش جانشینی دوگانه» (metathesis reactions) تقسیم میشود.
«واکنش بازآرایی» (Rearrangement reaction): گونهای از واکنشهای آلی است که طی آن ساختار اسکلتی ماده تغییر میکند و یک گروه از کربنی از مولکول جدا شده و به کربن دیگر متصل میشود.
بازآرایی-۲،۱ گونهای از واکنش بازآرایی در شیمی آلی است که طی آن یک زنجیرهی جانبی در یک ترکیب آلی از محل خود جدا و به اتم دیگری متصل شده و استخلاف جدیدی را ایجاد میکند.
واکنش پریسایکلیک عبارت است از نوعی واکنش آلی که در آن حالت گذار یک مولکول یک هندسهی بسته (حلقه) دارد و واکنش به صورت واکنش همزمان پیش میرود.
واکنشهای تراکمی
در «واکنشهای تراکمی» (condensation reactions) دو واکنشدهنده ترکیب و یک مولکول کوچک (معمولا آب) از آنها جدا میگردد. بر عکس این واکنش، هنگامی که در واکنش، آب مصرف گردد، آن را «هیدرولیز» (hydrolysis) مینامند. اکثر واکنشهای «پلیمریزاسیون» (polymerization) از واکنشهای آلی بدست میآیند. این واکنشها به دو دستهی پلیمریزاسیون اضافی (addition polymerization) و پلیمریزاسیون گام به گام (step-growth polymerizations) تقسیم میشود. نمونهای از واکنش پلیمریزاسیون که منجر به تولید «پلیمر یا بسپار» (polymer) میگردد، در ادامه قابل مشاهده است.
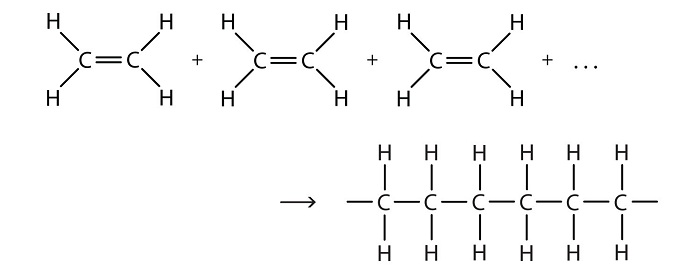
عمده ترین مواد پلیمری تولیدی در صنعت پتروشیمی شامل پلی اتیلن، پلی اتیلن ترفتالات، پلی پروپیلن، پلی وینیل کلراید، پلی استایرن، اکریلونیتریل و بوتادین استایرن هستند. هر یک از مواد نامبرده در فوق، خواص ویژه ای داشته و در یکی از صنایع لاستیک یا پلاستیک کاربرد دارند. به عنوان مثال، پلیمر پلی اتیلن برای ساخت انواع لوله پلی اتیلن و اتصالات به کار می رود و یا از پلی اتیلن ترفتالات برای سیستم های تزریق پلاستیک استفاده می شود.

سینتیک شیمیایی
سرعت واکنش شیمیایی با اندازهگیری تغییرات غلظت یا فشار مواد درگیر واکنش با زمان به دست میآید. تجزیه تحلیل سرعتهای واکنش برای کاربردهای گوناگون اهمیت دارد؛ از جمله در مهندسی شیمی یا مطالعات تعادل شیمیایی «سینتیک
واکنش» (reaction kinetics) بسیار مهم است. سرعتهای واکنش به طور عمده به عوامل زیر بستگی دارد:
غلظتهای واکنش دهنده: که عموما به دلیل افزایش تعداد برخورد مولکولها در واحد زمان، نسبت مستقیمی با سرعت واکنش دارد.
مساحت سطح در دسترس برای تماس بین واکنشدهندهها: این عامل به خصوص برای جامدات در سیستمهای ناهمگن تاثیر به سزایی دارد. مساحت سطوح بزرگتر منجر به سرعتهای واکنش بالاتر میگردد.
فشار: با افزایش فشار، حجم بین مولکولها کاهش مییابد. این عمل باعث افزایش تناوب برخوردهای مولکولها خواهد شد.
انرژی فعالسازی: که با عنوان مقدار انرژی مورد نیاز برای شروع واکنش و ادامهی آن به صورت خود به خودی تعریف میشود. انرژی فعالسازی بالاتر نشان دهندهی نیاز واکنشدهندهها به انرژی بیشتر برای شروع واکنش نسبت به انرژی فعالسازی پایینتر است.
دما: افزایش دما به واکنشها سرعت میبخشد. از آنجایی که دمای بالا انرژی مولکولها را افزایش میدهد، باعث برخوردهای بیشتر بین مولکولها در واحد زمان میگردد.
وجود یا عدم وجود یک کاتالیست: کاتالیستها موادی هستند که مسیر (مکانیسم) یک واکنش را تغییر میدهند. این تغییر مسیر سرعت یک واکنش را با کاهش انرژی فعالسازی مورد نیاز برای انجام واکنش، افزایش میدهد. یک کاتالیست در طول یک واکنش تغییر نمیکند و از بین نمیرود؛ بنابراین میتوان دوباره از آن استفاده کرد.
برای بعضی واکنشها، حضور پرتو الکترومغناطیس، به ویژه پرتوی فرابنفش، برای شکستن پیوندها جهت شروع واکنش، نیاز است. این مطلب به ویژه برای واکنشهای شامل رادیکالها صدق میکند.
سرعتهای واکنش به غلظتهای مواد موجود در واکنشها بستگی دارد. سرعتها توسط «قانون سرعت» (rate law) تعیین میشوند. توجه شود که سرعت بعضی واکنشها مستقل از غلظتهای واکنشدهنده هستند. این واکنشها را واکنشهای «صفر درجه» (zero order) مینامند.