اسید سولفوریک یک اسید معدنی قوی و بسیار خورنده با فرمول مولکولی H2SO4 است. این اسید یک مایع چسبناک بی رنگ یا زرد رنگ است که در غلظت های مختلف در آب قابل حل می باشد. سولفوریک اسید یک دیپروتیک اسید است و خواص مختلفی که از خود نشان می دهد بستگی به غلظت آن دارد. این اسید خاصیت خورندگی مواد از جمله فلزات، بافت زنده(مثل پوست و گوشت) و حتی سنگ را دارد که این خاصیت را می توان به ماهیت اسیدی قوی آن نسبت داد و در صورت غلیظ بودن دارای خاصیت نم زدا و اکسید کنندگی قوی می باشد. اسید سولفوریک قوی به محض تماس می تواند آسیب های جدی وارد کند مثلا باعث سوختگی شیمیایی از طریق هیدرولیز می شود همچنین باعث سوختگی های حرارتی ثانویه با از دست دادن آب بدن می شود. اگر با چشم تماس پیدا کند باعث سوختگی قرنیه و کوری دائم شود. بر این اساس باید احتیاطات لازم هنگام کار با اسید سولفوریک عایت شود. علاوه بر این اسید سولفوریک رطوبت پسند است و به راحتی بخار آب را از هوا جذب می کند.
استفاده از اسید سولفوریک شامل طیف گسترده ای از برنامه های کاربردی از جمله تخلیه اسیدی، استفاده به عنوان الکترولیت در باتری های سربی اسیدی و استفاده برای عوامل مختلف پاک کنندگی است. این اسید یک ماده اصلی در صنایع شیمیایی می باشد . استفاده اصلی شامل فراوری مواد معدنی، تولید کود، پالایش نفت، پردازش فاضلاب، و سنتز شیمیایی است .فرآیند نیترودار کردن در صنایع تولید مواد منفجره مانند تولید ترینیتروتولوئن (TNT) ، نیترو گلیسیرین و … استفاده میشود. اسید سولفوریک در انبارههای سربی (باطریهای سربی) به عنوان محلول الکترولیت استفاده میشود.
اسید سولفوریک ، یک عامل آبگیری بسیار قوی است. در اکثر واکنشها به عنوان عامل هیدراتاسیون استفاده میشود و در تولید میوههای خشک هم به میزان کم ، از اسید سولفوریک برای جذب آب استفاده میکنند.
تولید صنعتی اسید سولفوریک به روش تماسی:
در سال 1832 یک تاجر انگلیسی سرکه ، روشی اقتصادی برای تولید  و اسید سولفوریک غلیظ ابداع کرد که امروزه به نام فرآیند تماسی معروف است و قسمت اعظم اسید سولفوریک در دنیا به این روش تولید میگردد. این فرآیند در سه مرحله صورت میگیرد که عبارتند از :
و اسید سولفوریک غلیظ ابداع کرد که امروزه به نام فرآیند تماسی معروف است و قسمت اعظم اسید سولفوریک در دنیا به این روش تولید میگردد. این فرآیند در سه مرحله صورت میگیرد که عبارتند از :
-
تهیه و خالص سازی
 :
:خالص سازی
 و هوا برای جلوگیری از مسمومشدن کاتالیزور لازم است. گازها پس از شستشو با آب ، با اسید سولفوریک خشک میشوند.
و هوا برای جلوگیری از مسمومشدن کاتالیزور لازم است. گازها پس از شستشو با آب ، با اسید سولفوریک خشک میشوند. -
اکسیداسیون کاتالیکی
 به
به  :
: با
با 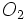 در دمای بالاتر از 450 درجه سانتیگراد و فشار 2atm و کاتالیزور پنتا اکسید وانادیم ، واکنش داده و
در دمای بالاتر از 450 درجه سانتیگراد و فشار 2atm و کاتالیزور پنتا اکسید وانادیم ، واکنش داده و  تولید میکند.
تولید میکند.  تولید شده از میانتبادلگر گرمایی عبور داده شده و در اسید سولفوریک غلیظ حل شده و تولید الئوم میکند. به دلیل اینکه انحلال
تولید شده از میانتبادلگر گرمایی عبور داده شده و در اسید سولفوریک غلیظ حل شده و تولید الئوم میکند. به دلیل اینکه انحلال  در آب بسیار گرمازا بوده و بجای اسید سولفوریک مایع ، مه تولید میشود، انحلال مستقیم
در آب بسیار گرمازا بوده و بجای اسید سولفوریک مایع ، مه تولید میشود، انحلال مستقیم  در آب عملی نمیباشد.
در آب عملی نمیباشد.
تولید سولفوریک اسید:
سولفوریک اسید، یکی از مهم ترین مواد شیمیایی صنعتی است که با استفاده از فرایند مجاورت تولید می شود. در مرحله نخست گوگرد در مجاورت اکسیژن اکسید شده و گوگرد دی اکسید به دست می آید.
-
S (s) + O۲ (g) → SO۲ (g)
در مرحله بعد گوگرد دی اکسید در مجاورت یک کاتالیزور به SO۳ اکسیده می شود.
-
۲ SO۲ + O۲ (g) → ۲ SO۳ (g)
واکنش بالا در دمای معمولی بسیار کند است. لذا در روش صنعتی، از دماهای بالا تر(۴۰۰C تا۷۰۰C) و از یک کاتالیزور (مانند وانادیم پنتوکسید V۲O۵ یا اسفنج پلاتین) استفاده می شود. با دمیدن بخار گوگرد تری اکسید به درون اسید سولفوریک، پیروسولفوریک اسید H۲S۲O۷تشکیل می شود.
-
H۲SO۴ (l) + SO۳ → H۲S۲O۷ (l)
سپس با افزودن آب به پیرو سولفوریک اسید، محلول سولفوریک اسید با غلظت مورد نظر را تهیه می کنند.
-
H۲S۲O۷ (l) + H۲O(l) → ۲ H۲SO۴ (l)
کنترل این روش که در آن، پیروسولفوریک اسید تشکیل می شود، آسان تر از واکنش مستقیم گوگرد تری اکسید با آب است.
-
SO۳ (g) + H۲O (l) → H۲SO۴ (l)




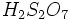 ایجاد میشود. واکنش اسید سولفوریک با آب بسیار گرمازا میباشد. اضافه کردن آب به اسید سولفوریک غلیظ خطرناک است. زیرا در اثر حرارت حاصل از واکنش اسید و آب ، آب داغ ممکن است به اطراف پراکنده شود.
ایجاد میشود. واکنش اسید سولفوریک با آب بسیار گرمازا میباشد. اضافه کردن آب به اسید سولفوریک غلیظ خطرناک است. زیرا در اثر حرارت حاصل از واکنش اسید و آب ، آب داغ ممکن است به اطراف پراکنده شود.