خواص شیمیایی انیدرید سولفورو SO2 را می توان بصور زیر بررسی کرد:
۱– پایداری گوگرد دی اکسید : انیدرید سولفورو گازی است بسیار با ثبات و فقط در درجه حرارتهای بسیار زیاد تجزیه می شود بطوریکه در درجه حرارتی بالاتر از درجه سانتی گراد یا در اثر جرقه الکتریکی بسختی تجزیه شده و گوگرد و SO3 تولید می نماید. گاز وقتی که خالص و خشک باشد اثری بر روی کاغذ معرف (مثلاً اثری بر روی کاغذ تورنسل) ندارد.
۲– خاصیت احیاکنندگی گاز گوگرد دی اکسید: گاز گوگرد دی اکسید یکی از احیاکنندگان نسبتاً قوی می باشد بطوریکه اکسیژن بسیاری از ترکیبات اکسیدکننده را جذب نموده و درجه اکسیداسیون ۴+ (موجود در خودش) را به ۶+ (موجود در SO۳ یا در یون سولفات حاصل) تبدیل می نماید که آنرا می توان در قسمتهای زیر بررسی نمود:
الف- ترکیب با اکسیژن: گاز SO2 و اکسیژن در سرما با همدیگر ترکیب نمی شوند ولی در اثر حرارت میان آن دو گاز تعادل زیر برقرار می شود:
۲SO2 + O2 → ۲SO3 + Q
ولی واکنش فوق در مجاورت کاتالیزور طلای سفید (یا پنتا اکسید وانادیم ) در دمای ۴۵۰ درجه سانتی گراد کامل میشود.
ب- اثر اجسام اکسیدکننده: اکسیدکننده های زیادی هستند که محلول گاز سولفورو را اکسید می نمایند مانند آب کلر، آب برم، آب ید، محلول پرمنگنات پتاسیم در محیط اسید سولفوریک، محلول بیکرومات پتاسیم در محیط اسید سولفوریک، آهن(III)کلرید ، طلا(III)کلرید و پراکسید ئیدروژن.
آب کلر بر گاز SO2 طبق فرمول زیر اثر می نماید و تولید اسید سولفوریک و اسید کلریدریک می گردد:
SO2 + Cl2 + 2H2O → H2SO4 + 2HCl
آب برم هم مانند آب کلر بر اثر می کند ولی در این حالت یک تعادل شیمیایی بصورت زیر برقرار میگردد:
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
آب ید بصورت محلول بسیار رقیق مانند آب برم بر SO2 اثر می کند و واکنش انجام گرفته هم کامل است، از این واکنش برای اندازه گیری مقدار SO2 موجود در آب استفاده می نمایند و فرمول آن بقرار زیر است:
SO2 + I2 + 2H2O → H2SO4 + 2HI
محلول نمک های اکسیدکننده مانند پرمنگنات پتاسیم، بیکرومات پتاسیم، کلریدفریک و کلریداوریک می توانند گاز سولفورو را اکسید نمایند.
محلول پرمنگنات پتاسیم یا کاغذ آغشته به آن توسط گاز سولفورو بیرنگ می گردد یعنی پرمنگنات پتاسیم احیا و گاز سولفورو اکسید می گردد:
۵SO2 + 2KMnO4 + 3H2SO4 → MnSO4 + K2SO4 + 3H2O
بیکرومات پتاسیم گاز سولفورو را اکسید کرده و در نتیجه کروم از درجه اکسیداسیون ۶+ به کروم با درجه اکسیداسیون ۳+ تبدیل می شود:
۳SO2 + K2Cr2O7 + 3H2SO4 → Cr2(SO4)3 + K2SO4 + H2O
در اثر محلول گاز سولفورو آهن (III) در کلریدفریک به آهن (II) تبدیل می گردد:
محلول گاز SO2 می تواند محلول طلا(III)کلرید را احیا کرده و طلا آزاد سازد:
۳SO2 + 2AuCl3 + 6H2O → ۲Au + 3H2SO4 + 6HCl
محلول آب اکسیژنه گاز SO2 را به اسید سولفوریک تبدیل می کند:
SO2 + H2O2 → H2SO4
بی اکسید سرب تازه تهیه شده گاز SO2 را جذب کرده و سولفات سرب بوجود می آورد:
SO2 + PbO2 → PbSO4
از این واکنش استفاده کرده و گاز SO2 را از سایر گازها (که بصورت مخلوط با آنها می باشد) مثلاً از گاز CO2 جدا می کنند.
۳- اثر SO2 بر اجسام آلی: گاز SO2 رنگ بسیاری از مواد آلی را از بین می برد (خاصیت رنگبری گاز SO2) مثلاً اگر در ظرفی که دارای گاز SO2 است گل سرخی را قرار دهیم بیرنگ می گردد ولی همین گل سرخ بیرنگ شده در مجاورت هوا دوباره قسمتی از رنگ خودش را باز می یابد. ویولت هم که یک رنگ آلی (از رنگ های تری فنیل متان) می باشد در اثر گاز بیرنگ شده و بلافاصله در مجاورت هوا رنگ اولیه اش را بدست می آورد.
پارافوشین که یک ترکیب آلی برنگ قرمز می باشد توسط گاز SO2 بیرنگ می شود.
از خاصیت رنگبری گاز SO2 در لباس شویی برای از بین بردن لکه میوه ها استفاده می کنند، همچنین برای سفید کردن مواد حساسی مانند پشم و ابریشم و کاه که کلر آنها را فاسد می کند استفاده می نمایند. برای گندزدایی، رنگبری، پیشگیری از کرم زدن (بعدی) و خوش رنگ شدن بعضی از میوه ها، هنگام خشک کردن آنها از گاز SO2 استفاده می کنند.
۴- خاصیت اکسیدکنندگی گاز SO2 : گاز SO2 با اینکه دارای قدرت احیاکنندگی فوق العاده زیادی است گاهی اوقات در اثر احیاکنندگان بسیار قوی خاصیت اکسیدکنندگی از خود نشان می دهد یعنی اکسیژنهای خودش را از دست می دهد. گاز در اثر ئیدروژن نوزاد گاز تولید می کند، یعنی ئیدروژن نوزاد، گاز SO2 را احیا کرده، و به H2S تبدیل می نماید طبق فرمول زیر:
هیدرووژن نوزاد
SO2 + 6H. → H2S +2H2O
ئیدروژن با گاز SO2 در مجاورت کاتالیزور نیکل (احیا شده) در دمای ۴۰۰ تولید H2S می نماید طبق فرمول زیر:
کاتالیزگر نیکل احیا شده
SO2 + 3H2 → H2S +2H2O
در صورت عدم مصرف کاتالیزور نیکل، واکنش فوق در دمای ۶۰۰ درجه سانتی گراد هم امکان نخواهد داشت برای اینکه واکنش بصورت زیر خاتمه خواهد یافت (یعنی گوگرد آزاد خواهد شد):
دمای ۶۰۰ درجه سانتی گراد
SO2 + 2H2 → S +2H2O
محلول SO2 می تواند گاز H2S را اکسید نماید، یعنی اگر گاز H2S را در محلول SO2 وارد نمایند گوگرد چسب مانندی آزاد می شود که فرمول واکنش چنین است:
SO2 + H2O + 2H2S → ۳S +3H2O
باید دانست که هر گاه هر دو گاز (SO2 و H2S) خشک باشند واکنش فوق انجام نمی گیرد و واکنش در فضایی انجام می گیرد که آب موجود باشد. پس در احیای SO2 توسط H2S آب به صورت کمک واکنش وارد عمل می شود.
در حرارت قرمز گاز SO2 می تواند کربن را اکسید کرده و به CO و تبدیل نماید طبق فرمولهای زیر:
SO2 + C → CO2 + S
SO2 + 2C → ۲CO + S
گوگرد آزاد شده ممکن است با منوکسیدکربن حاصل ترکیب و COS (اکسی سولفور کربن) به وجود آورد و یا در ۷۰۰ الی ۸۵۰ با کربن ترکیب شده و CS2(دی سولفور کربن) تولید نماید.
در حرارت بالاتر از ۱۱۰۰ فقط CO و بخار گوگرد وجود خواهد داشت که منوکسید کربن حاصل طبق فرمول زیر گاز SO2 را احیا کرده و گاز CO2 و گوگرد تولید می کند:
SO2 + 2CO → ۲CO2 + S
۵- فعل و انفعالات افزایشی SO2 در اثر غیر اشباع بودن ساختمان الکترونی: چون ساختمان الکترونی SO2 غیر اشباع است بدانجهت می تواند (یعنی می تواند) با تعداد بیشتری از اتم ها و مولکول های مختلف ترکیب شده و فعل و انفعالات افزایشی انجام دهد. مثلاً گاز SO2 با اکسیژن در درجه حرارتی بین ۴۰۰ تا ۷۰۰ در مجاورت کاتالیزور پلاتین (که به صورت ذرات بسیار ریز پلاتین است) یا پنتا اکسید وانادیم ترکیب شده و SO3 به وجود می آورد که با فرمول زیر نمایش داده می شود:
۲SO2 + O2 → ۲SO3 + Q
گاز SO2 با گاز Cl2 در مقابل نور خورشید ترکیب اضافی کلرور سولفوریل را تولید می کند طبق فرمول زیر:
نورخورشید-سولفوریل کلرید
SO2 + Cl2 → ۲SO2Cl2
و به همان ترتیب از ترکیب SO2 با گاز فلوئور ترکیب اضافی فلوئورو سولفوریل به وجود می آید:
نورخورشید-سولفوریل فلئورید
SO2 + F2 → ۲SO2F2
که فرمول اتحاد گازهای کلروفلوئور را با گاز SO2 می توان با فرمول کلی زیر نمایش داد:
SO2 + X2 → ۲SO2X2
گاز SO2 با محلول بسیار رقیق ید ترکیب و تولید H2SO4 و HI می نماید (قبلاً فرمول آن نوشته شده است) و HI حاصل نیز با یک مولکول SO2 طبق فرمول زیر ترکیب اضافی به وجود می آورد:
SO2 +HI → HISO2
بطوری که می دانیم گاز SO2 به راحتی در آب حل می شود و در موقع حل در آب با آن ترکیب و محلول اسید سولفورو به وجود می آورد. اسید سولفورو یک اسید ضعیف و ناپایدار دی پروتیک می باشد و طرز به وجود آمدن آن را از افزایش گاز SO2 بر آب به وسیله تعادل زیر می توان نمایش داد:
SO2 +H2O → H2SO3
و اسید سولفورو طبق تعادلات زیر تفکیک می شود:
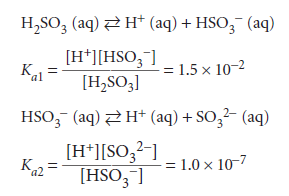
بطوریکه مشاهده می شود ثابت تعادل مربوط به دو عامل اسیدی H2SO3 با همدیگر تفاوت فوق العادهای دارند و در نتیجه قدرت دو اسیدیته آن فوق العاده متفاوت است.
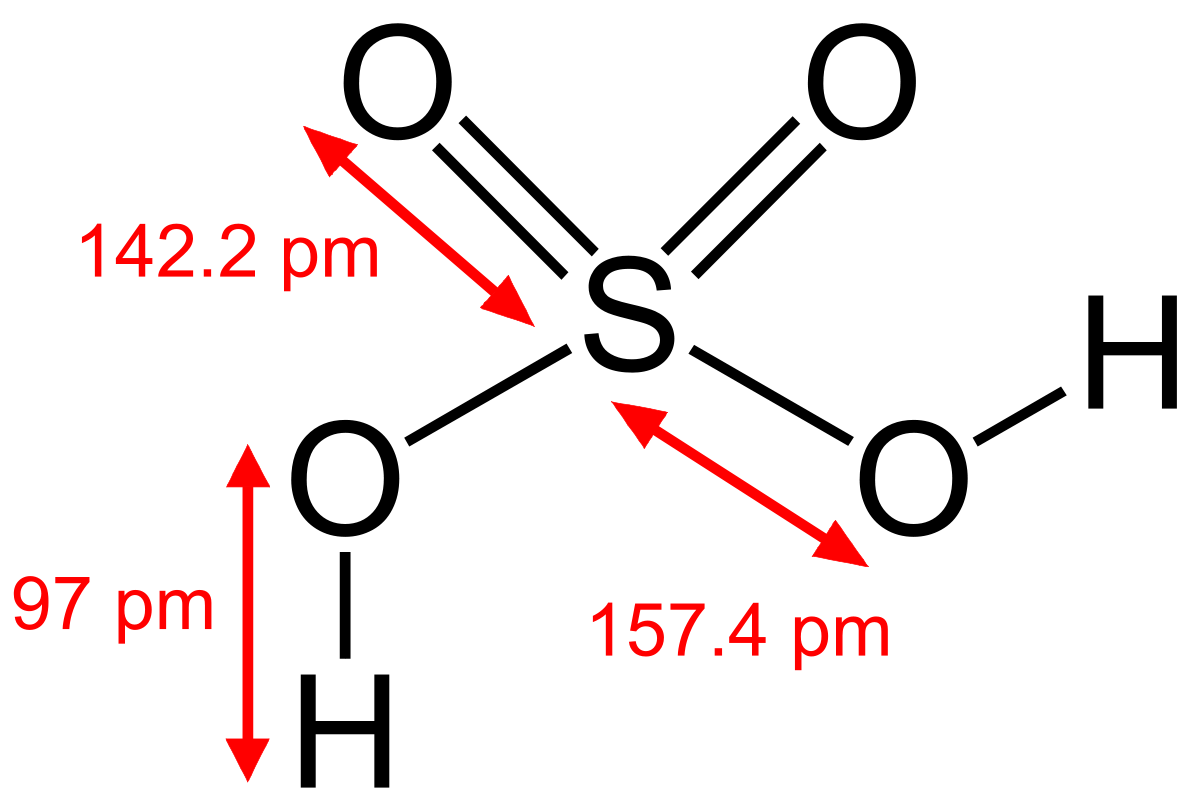
ساختار سولفورو اسید را به صورت زیر می توان آنها را نمایش داد: